論文紹介LUCUBRATIONS
Ca拮抗薬の臨床応用
-適応病型病態とCa拮抗薬種類の選択、使用法、臨床評価と問題点-
不整脈
Use of calcium antagonists for cardiac arrhythmias

Ca拮抗薬の臨床応用
ー適応病型病態とCa拮抗薬種類の選択、使用法、臨床評価と問題点ー
不整脈
Use of calcium antagonists for cardiac arrhythmias
満岡孝雄、橋場邦武
日本臨牀(8): 134-143, 1989.
はじめに
最近、Ca拮抗薬は化学構造の面から、
- ①nifedipine, nicardipineなどのdihydropyridine系、
- ②verapamil, gallopamilなどのphenylalkylamine系、
- ③diltiazemのbenzothiazepine系
の3つに大きく分類されているが、これは同時に薬理作用上の特徴にもとづく分類にもなっている。すなわち、dihydropyridine系は血管にきわめて選択的に作用し、phenylalkylamine系は心臓に対する作用が強い。Benzothiazepine系は血管と心臓の両方に作用し、dihydropyridine系とphenylalkylamine系の中間に位置する。したがって、phenylalkylamine系とbenzothiazepine系のCa拮抗薬が不整脈の治療薬としてその効果が期待される。このほか、以上の分類にはあてはまらないが、特殊なCa拮抗薬で抗不整脈薬として期待されているものにbepridilがある。
抗不整脈薬として臨床的にすでにその有用性が認められているものはphenylalkylamine系のverapamilとbenzothiazepine系のdiltiazemである。この両者は心臓に対する類似の電気生理的作用を有し、Vaughan Williamsの抗不整脈薬分類ではIV群に属する1)。本稿ではおもに不整脈の治療におけるverapamilとdiltiazemの適応と効果について概説する。
I. Ca拮抗薬の抗不整脈作用
心筋細胞の活動電位には、fast response型とslow response型とが認められる。Fast response型の活動電位はNaイオンの急速な細胞内流入によって生じ、心房固有筋、His-Purkinje線維および心室固有筋で認められる。一方、slow response型の活動電位はCaイオンの緩徐な細胞内流入によって生じ、洞結節や房室結節で認められる。Fast response型の活動電位を示す心筋細胞でも、病的状態ではslow response型の活動電位に変化しうる。
Ca拮抗薬は心筋細胞膜のCaチャンネルをブロックしてCaイオンの緩徐な細胞内流入を抑制することにより、slow response型の活動電位を有する心筋細胞の自動能や伝導能を抑制する。例えば、洞結節に対してCa拮抗薬は洞結節細胞の拡張期脱分極速度を抑制することによって心拍数を減少させ、また、活動電位0相の立ち上がり速度とその振幅を減少させて伝導性の低下をもたらす。房室結節細胞においてもCa拮抗薬の同様の作用によって伝導性の低下が生じ房室伝導時間は延長する。また、房室結節の有効不応期および機能的不応期も延長する。しかし、fast response型の活動電位を認める心房、心室、His-Purkinjeおよび副伝導路などの心筋細胞では伝導時間や不応期はほとんど変化しない。以上のような電気生理的作用を基礎としてCa拮抗薬は抗不整脈作用を発揮する。臨床的には、
- ①slow response型の活動電位を示す心筋細胞を興奮回旋路に含むリエントリー性頻拍の停止や予防、
- ②頻拍性心房細(粗)動の心拍数の減少、
- ③slow response型の活動電位を示す心筋細胞の自動能亢進による不整脈の抑制、
などの効果が期待される。特殊なCa拮抗薬であるbepridilはverapamilやdiltiazemとは異なり、slow response型の活動電位を抑制するほかに、fast response型の活動電位をも抑制し、活動電位持続時間を延長することが知られている。
不整脈は一般的には刺激生成異常、刺激伝導異常(リエントリー性不整脈)、およびその両者の組み合わせで発生するが、最近、第3の可能性としてtriggered activityが細胞レベルからみた不整脈の発生機序として注目されている2)。Triggered activityとは活動電位の終末部付近あるいはその直後に生じた小さな脱分極性の膜電位変化(afterdepolarization)が、その振幅を増加して閾値に到達した結果生じた自発興奮であり、これが反復して生じると頻拍となる3)。Triggered activityをもたらすafterdepolarizationには細胞内Caイオンの増加が関係しているため、Ca拮抗薬はtriggered activityに対して抑制的に作用する3)。Triggered activityが臨床上の不整脈発生にどのような役割を演じているかについては十分に明らかではない。しかし、いくつかの状況証拠によってtriggered activityの関与が示唆される臨床的不整脈4)があり、そのような例に対してCa拮抗薬の効果が期待される。
II. 各種不整脈に対するCa拮抗薬の適用
1.上室性不整脈
1)発作性上室性頻拍
a.頻拍の停止
発作性上室性頻拍(paroxysmal supraventricular tachycardia, PSVT)のほとんどがリエントリーによるもので、その大部分は副伝導路を通るWPW症候群と房室結節内リエントリーとである。WPW症候群では、心房→房室結節→His束→心室→副伝導路→心房の興奮回旋の反復により房室回帰性頻拍とよばれるPSVTを生じる。房室結節内リエントリー性頻拍は房室結節に限局したリエントリー回路によるものである。両者は興奮回旋路に房室結節をともに含むため、これらによる頻拍発作の停止にCa拮抗薬は有効である。洞結節性リエントリー性頻拍ではCa拮抗薬が洞結節あるいはその近傍をブロックして頻拍を停止することが考えられるが、房室結節内リエントリー性頻拍に対する効果と比較すると劣るようである。心房内リエントリー性頻拍に対するCa拮抗薬の効果はあまり期待できない。
VerapamilはPSVTの頻拍停止にきわめて有効で、5〜10mgのverapamilを15〜60秒で静注すると、房室結節内リエントリー性頻拍では88〜100%が停止し5)6)7)、房室回帰性頻拍では67〜100%が停止を、停止しなかった例でも頻拍のレートが減少する5)6)7)ことなどが報告されている。Diltiazemにもverapamilと同様にPSVTの発作停止効果が認められている。著者らは早い時期より不整脈に対するdiltiazemの静注効果について検討してきたが8)9)、房室回帰性頻拍6例にdiltiazem 0.2mg/kgを5分で静注すると、3例でPSVTの停止(図1)を、停止しなかった残りの3例においても頻拍レー卜の減少を認めた8)。BetriuらはPSVT 15例にdiltiazem 0.15〜0.30mg/kgを2分で静注し、13例(86.7%)に頻拍の停止を認めたと報告している10)。HungらはPSVT 30例にdiltiazem 0.2mg/kgを1分で静注し、24例(80.0%)で頻拍停止を、6例(20.0%)で頻拍レートの減少を認めたと報告している11)。このほかに、PSVT例で心臓電気刺激法によって誘発された頻拍に対するdiltiazemとpropranolol、あるいはverapamilとpindololなどの併用一回経口投与による停止効果が検討され、それぞれ有効であることが報告されている12)13)。
図1. 潜在性WPW症候群による発作性上室性頻拍(18歳男)に対するdiltiazem(0.2mg/kg)静注の効果
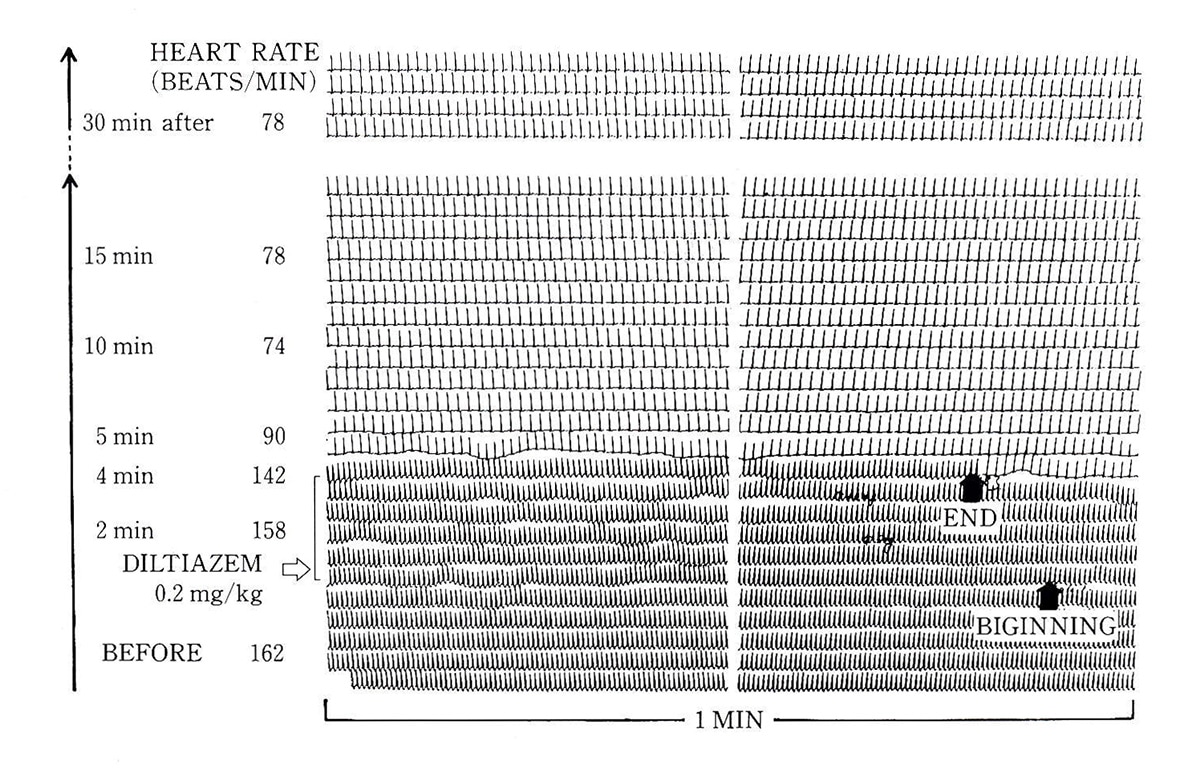 記録は長時間心電図記録装置を用い、下段から上段の方向へ記録されている。頻拍のレートは静注開始直前の162/分から142/分へと減少し、静注終了とともに頻拍は停止している。
記録は長時間心電図記録装置を用い、下段から上段の方向へ記録されている。頻拍のレートは静注開始直前の162/分から142/分へと減少し、静注終了とともに頻拍は停止している。
b.頻拍発作の予防
Ca拮抗薬は頻拍発作の予防にも有効であることが期待され検討されているが、頻拍発作時の静注による著明な停止効果と比較すると、予防効果は多少劣るとされている6)14)15). Rinken-bergerらはPSVT 10例に180〜480mg/日のverapamilを平均19力月間投与した結果、6例(60.0%)で頻拍発作の減少や持続時間の短縮を認めたとしている6)。HungらはPSVT 12例に270mg/日のdiltiazemを2〜13カ月にわたり経口投与した。その結果8例(66.7%)では頻拍発作が生じなくなり、4例(33.3%)では頻度の減少と持続時間の短縮を認めたと報告している11)。
以上のようにPSVTに対するCa拮抗薬の予防効果を判定するには長期間を要し、また、症例によっては頻拍発作の頻度の自然変動が激しいため薬物効果の判定が困難な場合も少なくない。このため最近ではCa拮抗薬の静注前後に心臓電気刺激法による頻拍誘発を試み、静注後の頻拍誘発抑制効果により、長期経口投与による頻拍予防効果を予測することも行われている。Tonkinらは心臓電気刺激法により誘発可能な房室結節内リエントリー性頻拍13例にverapamil 0.15mg/kgを静注し、5例(38.5%)では頻拍が誘発されず、3例(23.1%)では頻拍が誘発されても持続しなくなり、また、誘発抑制効果がなかった症例でも頻拍レートが減少することを報告した16)。その後これらの例に平均16力月にわたってverapamil 240〜360mg/日を経口投与し、13例中11例でPSVTの頻度の減少、持続時間の短縮、自覚症の改善などを認めている。Kleinらも頻拍誘発が可能であったPSVT 7例のうち6例(85.7%)でverapamil静注後に頻拍が誘発されなくなり、これらの例では長期経口投与中も頻拍発作を認めなくなったと報告している17)。
このような静注による判定のほかに短期間の経口投与後に頻拍誘発抑制効果を判定する方法も行われている。Wuらは頻拍誘発が可能であったPSVT 14例にverapamil 80mgを6時間ごとに4回経口投与し、最後の投与から5〜6時間後の誘発抑制効果は長期経口投与による頻拍発作の予防効果とよく一致すると報告している18)。Yehらは頻拍誘発が可能であったPSVT 36例にdiltiazem 90mgを8時間ごとに3回経口投与したところ、28例で頻拍誘発を認めなくなった。このうち13例に270mg/日のdiltiazemを平均5ヵ月間経口投与したところ、全例で頻拍発作が生じなくなったと報告している19)。
WPW症候群に伴うPSVTは房室結節を順行性に伝導するnarrow QRS波を有するPSVTがほとんどであるが、まれに心房→副伝導路→心室→His束→房室結節→心房と房室結節を逆行性に伝導するwide QRSのPSVTも認められる。この型のPSVTに対するCa拮抗薬の効果は十分に検討されていない。理論的にはCa拮抗薬が逆行性の房室伝導を抑制し、停止効果を示す可能性が考えられる。
2)心房細動、心房粗動
Ca拮抗薬の静注による心房細動や心房粗動の洞調律化はあまり多くはない。これはCa拮抗薬の影響が心房不応期に対してほとんど認められないことと関連している。しかし、Ca拮抗薬は房室伝導を抑制することによって頻拍性心房細動や心房粗動の心拍数を減少させ、また、心房細動の一部の症例においては不規則なR-R間隔が規則化することも報告されている20)。
Talanoらは心房細動と心房粗動に対するverapamil 5〜10mgの静注効果について7施設の成績をまとめ報告している21)。心房細動203例において10例(4.9%)で洞調律化を、190例(93.6%)では心拍数の減少を認め、心房粗動49例では12例(24.5%)で洞調律化を、30例(61.2%)では心拍数の減少を認めている。Diltiazemの心房細動と心房粗動に対する効果もverapamilと同程度と考えられる。われわれは発作性心房細動5例と心房粗動3例にdiltiazem 0.1〜0.2mg/kgを5分で静注した結果、洞調律化を認めた症例はなかったが、心房細動の全例で心拍数の減少を認め(図2)、また、心房粗動でも全例で房室伝導比の2:1から4:1への減少を認めた8)。Betriuらも発作性心房細動と心房粗動例にdiltiazem 0.15〜0.30mg/kgを2分で静注した結果、心房細動12例のうち2例(16.7%)で洞調律化を、8例(66.7%)で心拍数の減少を、また、心房粗動12例のうち3例(25.0%)で心房細動への移行を、6例(50.0%)で心拍数の減少を認めたと報告している10)。
図2. Diltiazem(0.1〜0.2mg/kg)静注による心房細動の心拍数減少
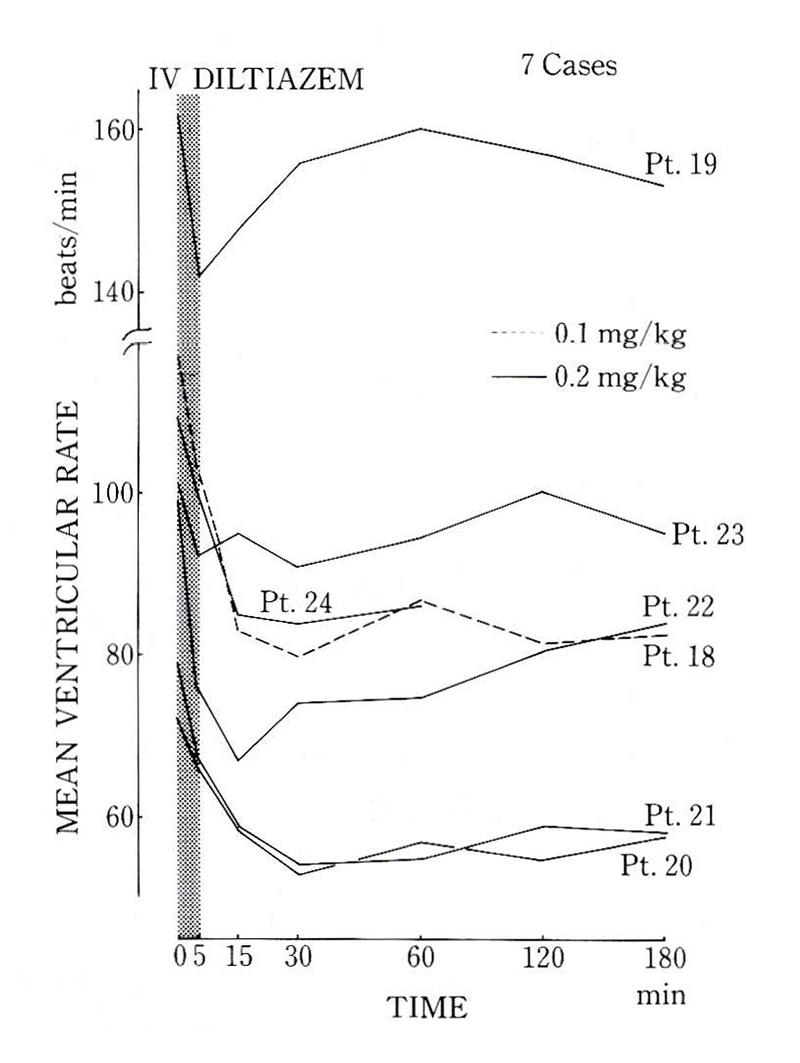 Diltiazem静注による洞調律化は認めなかったが、全例で心拍数の減少を認めている。IV: dil-tiazem静注
Diltiazem静注による洞調律化は認めなかったが、全例で心拍数の減少を認めている。IV: dil-tiazem静注
慢性心房細動や心房粗動の心拍数減少のためにCa拮抗薬の経口投与の効果も検討されている。KleinとKaplinskyは心房細動と心房粗動例における心拍数減少の効果をverapamil(240mg/日)とdigoxin(0.25mg/日)で比較し、安静時心拍数は両剤で同程度に減少するが、運動時心拍数の増加はverapamilによってより強く抑制されると報告している22)。われわれはdiltiazem(90mg/日)とdigoxin(0.25mg/日)について類似の検討をおこなっているが、diltiazemでも同様の結果を得ている23)。このように、Ca拮抗薬は慢性心房細動や心房粗動の心拍数減少にdigitalisよりもすぐれた効果を有していると考えられる。また、慢性心房細動や心房粗動の心拍数減少に対するCa拮抗薬とdigitalisとの併用効果も最近報告されている24)。
一方、顕在性WPW症候群に伴う心房細動に対してCa拮抗薬は禁忌とされている。その理由はdigitalisやβ-blockerなどと同様に房室結節の不応期が延長し、副伝導路を通る刺激頻度が増加して心拍数が増加し、心室細動や心室粗動などが生じる危険性が高まるためである6)8)。
最近、verapamil静注後に発作性心房細動がかえって誘発された症例25)26)や、心臓電気刺激法により心房細動が誘発されやすくなり、また、持続時間も長くなるなどの報告が認められる27)28)。顕在性WPW症候群のPSVTの頻拍停止、あるいは頻拍発作予防のためにCa拮抗薬が使用されていることを考慮すると、これらの問題は今後十分な検討が必要と思われる。
3)その他の上室性頻拍
上室性頻拍にはすでに述べたリエントリーの機序によるもののほかに、心房の異所性自動能亢進による頻拍も認められる。Rinkenbergerらは自動能亢進による上室性頻拍3例にverapamilを静注した結果、房室伝導抑制によってWenckebach型2度房室ブロックは生じたが、心房レートの変化は認めなかったと報告している6)。われわれも慢性心房性頻拍の1例にdiltiazemを静注して効果をみたが、頻拍停止を認めず、心房レートの変化も認めていない9)。Salernoらは多源性心房性步頻拍(multifocal atrial tachycardia)の16例にverapamilを平均17±7mg静注し、8例で洞調律化を、残りの8例でも心拍数の減少を認めたと報告している29)。多源性心房性頻拍の機序の一つとしてtriggered activityが示唆されているが、verapamilがこれを抑制した可能性も考えられる。
2.心室性不整脈
心室性不整脈の場となるHis-Purkinje線錐や心室固有筋などはfast response型の活動電位を示すため、一般に心室性不整脈に対するCa拮抗薬の効果は少ないと考えられている。しかし、虚血などによりfast response型の活動電位を有する心筋細胞がslow response型のそれに変化して生じたリエントリーやtriggered activityなどによる心室性不整脈にはCa拮抗薬の効果が期待できる可能性がある。
1)虚血性心疾患に伴う心室性不整脈
Frazzinらは急性心筋梗塞で心室性期外収縮(VPC)を頻発した8例にverapamilを0.1mg/kgを静注した結果、7例でVPCが消失したと報告している30)。Sclarovskyらは急性心筋梗塞後の12時間内に出現したmultiform accelerated idioventricular rhythmの6例にverapamil 3〜5mgを静注した結果、4例で消失を、1例でレートの減少を認めたと報告している31)。Grenadierらは心筋梗塞の急性期に出現した多形性心室頻拍にverapamilを静注し、4例中3例で頻拍の消失を認めたと報告している32)。Verapamilが有効であった3例はlidocaine、I群の抗不整脈薬、ペーシング、DCショックが無効であったという。以上の報告は急性心筋梗塞に合併した一部の心室性不整脈にCa拮抗薬が有効である可能性を示唆しているが、その作用機序につぃてはCa拮抗薬の直接的な抗不整脈作用と虚血を改善することによる2次的作用の両者が考えられる。急性心筋梗塞後の心室性不整脈の発生機序についてはリエントリー、異所性自動能亢進、あるいはtriggered activityのいずれによるかは明らかでないが、最近、心筋梗塞後1日目の心室性不整脈はtriggered activityによっても生じることが実験的に証明されている33)34)。
一方、心筋梗塞の慢性期に生じた慢性反復性持続性心室頻拍(chronic recurrent sustained ventricular tachycardia、CRSVT)に対するCa拮抗薬の効果は少ない。Sungらは陳旧性心筋梗塞例で心臓電気刺激法にて誘発可能なCRSVT 10例にverapamilを静注した結果、全例で心室頻拍(VT)誘発抑制効果は認められず、うち2例ではverapamilによって生じた血圧低下のためにDCショックが必要であったと報告している35)。一方、Masonらは陳旧性心筋梗塞例でVT誘発可能であったCRSVT 16例にverapamil 0.25mg/kgを静注し、3例にのみVT誘発抑制効果あるいは誘発VTの5秒以内の自然停止を認めたと報告している36)。陳旧性心筋梗塞例での慢性反復性持続性心室頻拍の機序としてはリエントリーが想定されているので、この型のリエントリーにはCa拮抗薬は無効であると思われる。
Buxtonらは持続性VTの自然発作で緊急入院した25例(うち陳旧性心筋梗塞は20例)に、verapamil 5〜10mgを静注したところ、11例(44%)で急激な血圧低下や意識消失をきたし、DCショックが必要となったと報告している37)。このことは陳旧性心筋梗塞例のVTにverapamil静注は無効であるばかりか危険でさえある可能性を示唆している。
2)心筋症に伴う心室性不整脈
Sungらは5例35)の、Masonらは3例36)の心筋症に伴う持続性心室頻拍について、心臓電気刺激法にてVTを誘発し、verapamilの効果をみているが、頻拍停止効果も、誘発抑制効果も認められなかったと報告している。
3)非持続性心室頻拍
Buxtonらは心臓電気刺激法にて誘発された3拍以上30秒以内のVTで自然停止する非持続性心室頻拍(non-sustained ventricular tachycardia)13例に対するverapamil 10mgの静注効果を検討したが、VT誘発抑制やVTレ—卜の減少などの効果は認められず、3例ではVTレートがかえって増加し、うち2例は心室細動に移行したと報告している38)。彼らはこれらの心室頻拍はtriggered activityによるものではないと考えている。
4)基礎心疾患のない心室性期外収縮
最近、Itoらは基礎心疾患を認めない心室性期外収縮(VPC)16例について、diltiazem(90〜180mg/日)経口投与の有効性を基本心拍数とVPCとの関係で検討し、心拍数の増加に伴って頻度が増加するVPCに対してdiltiazemは有効であったと報告している39)。心拍数が増加するにつれ多くなるVPCの機序として彼らはtriggered activityを想定している。
5)LAD+RBBB型QRSの特発性心室頻拍
明らかな基礎心疾患がなく、多くは若年者に認められ、発作時のQRSが左軸偏位(LAD)と右脚ブロック(RBBB)を示し、かつverapamilが有効である特発性心室頻拍(idiopathic ventricular tachycardia)が独立した新しい臨床的な概念として注目されている40)41)42)43)44)45)。これらの心室頻拍は通常は心房あるいは心室刺激のいずれでも誘発される。Oheらはこの特発性心室頻拍の14例にverapamil 10mgを静注した結果、13例で頻拍停止を認め、うち5例にverapamilの長期経口投与をおこなったところ、全例で頻柏の予防効果を認めたと報告している44)。この特発性心室頻拍の機序は不明であるが、slow response型の心筋細胞で構成される組織を回路に含むリエントリーやtriggered activityなとが考えられている。図3は当科にて経験した特発性心室頻拍の1例で、diltiazem静注にて頻拍は停止した。
図3. 特発性心室頻拍(18歳男)のdiltiazem(0.2mg/kg)静注による停止
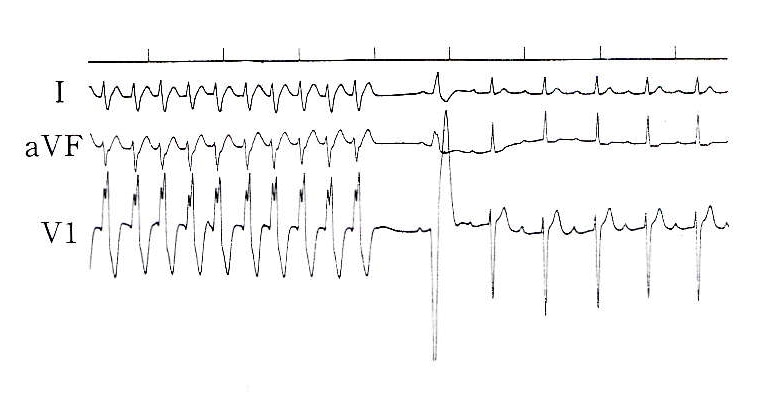
6)運動誘発性心室頻拍
基礎心疾患を認めず、運動により誘発され、VT時に左脚ブロックと右軸偏位のQRSを示す心室頻拍に対するverapamilの有効性が報告されている46)。WuらはこのようなVTの3例を運動誘発性心室頻拍(exercise-triggered ventricular tachycardia)として報告し、これらは心臓電気刺激法にて誘発されないが、isoproterenolの点滴によって誘発され、また、verapamilの静注によりVTは停止し、静注後には運動によってもVTは誘発されないとしている46)。このVTの機序として異所性自動能亢進とtriggered activityが推定されている。一方、Sungらは心臓電気刺激法にて誘発されず、isoproterenolの点滴によって誘発されるVT 7例についてverapamil静注点滴の効果を検討しているが、全例で無効であったと報告している35)。Sungらの症例がWuらのそれと類似のものかは明らかではないが、catecholamine-sensitive VTに対するverapamilの効果については今後の検討が必要である。
7)正常QTの"torsades de pointes"型多形性心室頻拍
CoumelとAttuelは
- ①基礎心疾患がない、
- ②QT間隔は正常である、
- ③先行QRSに対して1拍目のVPCの連結期は極端に短い(300msec以下)、
- ④"torsades de pointes"型の多形性心室頻拍を示す、
- ⑤失神発作を認める、
- ⑥βブロッカーやamiodaroneが無効である、
- ⑦verapamilの静注および経口投与が著効を示す、
などの特徴を有する3例を報告している47)。
8)心室性副調律
Massumiらはlidocaine、procainamideが無効でverapamilによって消失した心室性副調律の3例を報告し、これらの機序としてtriggered activityを示唆している48)。
III.不整脈に対するCa拮抗薬使用時の留意点一とくに自律神経との相互作用
Breithardtらは健常者にverapamilを静注すると洞周期は短縮し、propranololとatropineによる自律神経遮断後にverapamilを静注すると洞周期は延長することを報告している49)。動物実験でも同様のことが観察されている50)。これはverapamil静注による血管拡張によって血圧が低下し、神経反射を介して交感神経緊張が高まり、これによって洞結節に対するverapamilの直接作用が減弱して洞周期が短縮すると考えられ、また、神経反射を薬物によって遮断するとverapamilの洞結節に対する抑制作用が前面に出て洞周期が延長すると考えられる。これらのことは背景にある交感神経緊張状態によってverapamilの効果が修飾されることを示している51)。この神経反射が作動しにくい病的状態、たとえば一部の洞不全症候群ではverapamilの投与によって高度の徐脈を呈する可能性が示唆される52)。このほか、β遮断薬がすでに投与されている例では、通常量のverapamil投与でもしばしば重篤な副作用が生じることが報告されている53)54)。また、心房細動の心拍数抑制の目的でverapamilを用いる場合に心不全を合併する例では、合併しない例に比較してより多い量のverapamilが必要であったと報告されている55)。これは心不全時に交感神経緊張が高まり、血中のnorepinephrineが増加している56)ことと関係があると思われる。以上のようにverapamilの作用は背景にある交感神経の緊張状態によって左右される可能性がある。
Verapamilとdigoxinの相互作用により、digoxinの血中濃度は上昇することが報告されている57)。Diltiazemとdigoxinの相互作用については、digoxinの血中濃度を上昇させる58)、あるいは有意には上昇させない59)という報告があり一定の結論には達していない。Ca拮抗薬とdigoxinを併用する場合にはdigoxinの作用が増強される可能性があるので注意を要する。
IV. Ca拮抗薬の副作用
一般的に副作用として、心窩部不快感、腹部膨満惑、便秘、めまい、頭痛、神経不安、皮膚紅潮などを認めることがある。心血管系の副作用としては、血圧低下、洞性徐拍、洞停止、房室ブロックなどが多い。したがって、洞不全症候群、伝導障害、心不全などの症例に対する投与は慎重を要する。
おわりに
Verapamilが使用されるようになってから約20年が経過しようとしている。この間、一部の上室性不整脈に対するCa拮抗薬の有効性は確立されたと考えられるが、心室性不整脈に対するCa拮抗薬の効果に関してはいまだ十分な検討はなされていない。しかし、一部の心室性不整脈に対してCa拮抗薬は有効であることが示唆されているので、今後の解明がまたれる。
文献
- Vaughan Williams, E.M. : A classitication of anti-arrhythmic actions reassessed after a decade of new drugs. J. Clin. Pharmacol. 24:129, 1984.
- 平岡昌和ほか: Triggered activity(誘発活動)と不整脈. 心臓 19:760, 1987.
- Hiraoka, M. et al.: Oscillatory afterpotentials in dog ventricular muscle fibers. Circ. Res. 48:510, 1981.
- Brugada, P. & Wellens, H.J.J.: The role of triggered activity in clinical ventricular arrhythmias. PACE 7:260, 1984.
- Krikler, D.M. & Spurrell, R.A.J.: Verapamil in the treatment of paroxysmal supraventricular tachycardia. Postograd. Med. J. 50:447, 1974.
- Rinkenberger, R.L. et al.: Effects of intravenous and chronic oral verapamil administration in patients with supraventricular tachyarrhythmias. Circulation 62:996, 1980.
- Waxman, H.L. et al.: Verapamil for control of ventricular rate in paroxysmal supraventricular tachycardia and atrial fibrillation or flutter. Ann. Int. Med. 94:1,1981.
- Mitsuoka, T. et al.: The effects of intravenous diltiazem on supraventricular arrhythmias. Jpn. Heart J. 23 (Suppl. 1):124, 1982.
- 満岡孝雄ほか: 不整脈に対する diltiazem 静注の効果. 薬理と治療11 (Suppl. 1) :147, 1983.
- Betriu, A. et al.: Beneficial effect of intravenous diltiazem in the acute management of paroxysmal supraventricular tachyarrhythmias. Circulation 67:88, 1983.
- Hung, J. et al.: Usefulness of intravenous diltiazem in predicting subsequent electrophysiologic and clinical responses to oral diltiazem. Am. J. Cardiol. 4:1259, 1984.
- Yeh, S. et al.: Termination of paroxysmal supraventricular tachycardia with a single oral dose of diltiazem and propranolol. Circulation 71:104, 1985.
- Rose, J.S. et al.: Effective termination of reentrant supraventricular tachycardia by single dose oral combination therapy with pindolol and verapamil. Am. Heart J. 112:759, 1986.
- Sakurai, M. et al.: Acute and chronic effects of verapamil in patients with paroxysmal supraventricular tachycardia. Am. Heart J.105:619, 1983.
- Winniford, M.D. et al.: Long-term therapy of paroxysmal supraventricular tachycardia: A randomized, double-blind comparison of digoxin, propranolol and verapamil. Am. J. Cardiol. 54:1138, 1984.
- Tonkin, A.M. et al.: Verapamil in prophylaxis of paroxysmal atrioventricular nodal reentrant tachycardia. J. Cardiovasc. Pharm. 2:473,1980.
- Klein, G.J. et al.: Comparison of the electrophysiologic effects of intravenous and oral verapamil in patients with paroxysmal supraventricular tachycardia. Am. J. Cardiol. 49:117, 1982.
- Wu, D. et al.: Effects of oral verapamil in patients with atrioventricular reentrant tachycardia incorporating an accessory pathway. Circulation. 67:426, 1983.
- Yeh, S. et al.: Effects of oral diltiazem in paroxysmal supraventricular tachycardia. Am. J. Cardiol. 52: 271, 1983.
- Heng, M.K. et al.: Effects of intravenous verapamil on cardiac arrhythmias and on the electrocardiogram. Am. Heart J. 90:487, 1975.
- Talano, J.V. & Tommaso, C.: Slow channel calcium antagonists in the treatment of supraventricular tachycardia. Prog. Cardiovasc. Dis. 25:141, 1982.
- Klein, H.O. & Kaplinsky, E.: Digitalis and verapamil in atrial fibrillation and flutter. Is verapamil now the preferred agent? Drugs 31:185, 1986.
- Tanigawa, M. et al.: Effects of digoxin, diltiazem and propranolol on the heart rate in chronic atrial fibrillation. Jpn. Circ. J. 48:861, 1984.
- Steinberg, J.S. et al.: Efficacy of oral diltiazem to control ventricular response in chronic atrial fibrillation at rest and during exercise. J. Am. Coll. Cardiol. 9:405, 1987.
- Falk, R.H. et al.: Verapamil-induced atrial fibrillation. N. Engl. J. Med. 318:640, 1988.
- Belhassen, B. et al.: Sustained atrial fibrillation after conversion of paroxysmal reciprocating junctional tachycardia by intravenous verapamil. Am. J. Cardiol. 62:835, 1988.
- Kasanuki, H. & Ohnishi, S.: Verapamil increasing inducibility and persistence of atrial fibrillation. Circulation 74(Suppl. H):E-105, 1986.
- Shenasa, M. et al.: Effect oi intravenous and oral calcium antagonists (diltiazem and verapamil) on sustenance of atrial fibrillation. Am. J. Cardiol. 62:403, 1988.
- Salerno, D.M. et al.: Intravenous verapamil for treatment of multifocal atrial tachycardia with and without calcium pretreatment. Ann. Int. Med.107:623, 1987.
- Fazzim, P.F. et al.: Effects of verapamil on ventricular premature beats of acute myocardial infarction. Acta Cardiol. 33:25, 1978.
- Sclarovsky, S. et al.: Multiform accelerated idioventricular rhythm in acute myocardial infarction: Electrocardiographic characteristics and response to verapamil. Am. J. Cardiol. 52:43, 1983.
- Grenadier, E. et al.: Polymorphous ventricular tachycardia in acute myocardial infarction. Am. J. Cardiol. 53:1280, 1984.
- El-Sherif, N. et al.: Triggered ventricular rhythms in 1-day-old myocardial infarction in the dog. Circ. Res. 52:566, 1983.
- Anderson, G.L. & Swartz, J.: Triggered automaticity in acute myocardial infarction. Int. J. Cardiol. 12:445, 1983.
- Sung, R.J. et al.: Effects of verapamil on ventricular tachycardias possibly caused by reentry, automaticity, and triggered activity. J. Clin. Invest. 72:350, 1983.
- Mason, J.W. et al.: Efficacy of verapamil in chronic, recurrent ventricular tachycardia. Am. J. Cardiol. 51:1614, 1983.
- Buxton, A.E. et al.: Hazards of intravenous verapamil for sustained ventricular tachycardia. Am. J. Cardiol. 59:1107, 1987.
- Buxton, A.E. et al.: Electropharmacology of nonsustained ventricular tachycardia: Effects of class I antiarrhythmic agents, verapamil and propranolol. Am. J. Cardiol. 53:738, 1984.
- Ito, M. et al.: Effects of oral diltiazem on ventricular premature contractions. J. Electrocardiol. 19 : 59, 1986.
- Belhassen, B. et al.: Response of recurrent sustained ventricular tachycardia to verapamil. Br. Heart J. 46:679, 1981.
- Lin, F. et al.: Idiopathic paroxysmal ventricular tachycardia with a QRS pattern of right bundle branch block and left axis deviation: A unique clinical entity with specific properties. Am. J. Cardiol. 52:95, 1983.
- German, L.D. et al.: Ventricular tachycardia induced by atrial stimulation in patients without symptomatic cardiac disease. Am. J. Cardiol. 52:1202, 1983.
- Belhassen, B. et al.: Idiopathic recurrent sustained ventricular tachycardia responsive to verapamil: An ECG-electrophysiologic entity. Am. Heart J.108:1034, 1984.
- Ohe, T. et al.: Idiopathic sustained left ventricular tachycardia: clinical and electrophysiologic characteristics. Circulation. 77:560, 1988.
- Okumura, K. et al.: Entrainment of idiopathic ventricular tachycardia of left ventricular origin with evidence for reentry with an area of slow conduction and effect of verapamil. Am. J. Cardiol. 62:727,1988.
- Wu, D. et al.: Exercise-triggered paroxysmal ventricular tachycardia: A repetitive rhythmic activity possibly related to afterdepolarization. Ann. Int. Med. 95:410, 1981.
- Coumel, P. & Attuel, P.: Which arrhythmias are specifically susceptible to calcium antagonists ? In: Frontiers of cardiac electrophysiology (ed. by Rosenbaum, M.B., Elizari, M.V.), p. 341, Martinus Nijhoff, Boston, 1983.
- Massumi, R.A. et al.: Verapamil in parasystolic ventricular tachycardia and other wide QRS rhythms. Am. Heart J. Ill: 400, 1986.
- Breithardt, G. et al.:The role of the autonomic nervous system in the action of verapamil on the sinus node in man. Basic Res. Cardiol. 73:637, 1978.
- Qi, A. et al.: Potentiation of cardiac electrophysiologic effects of verapamil after autonomic blockade or cardiac transplantation. Circulation 75:888, 1987.
- 平田正信ほか: 洞結節自動能に対するverapamil と交感神経刺激との拮抗作用. 薬理と治療15 (Suppl. 3):11, 1987.
- Seipel, L. & Breithardt, G.: Electrophysiological actions of calcium antagonists in the heart. Cardiology 69 (Suppl. 1): 105, 1982.
- Krikler, D.: Verapamil in cardiology. Eur. J. Cardiol. 2:3, 1974.
- Benaim, M.F.: Asystole after verapamil. Br. Med. J. 2:169, 1972.
- Dominic, J.A. et al.: Verapamil plasma levels and ventricular rate response in patients with atrial fibrillation and flutter. Clin. Pharmacol. Ther. 26:710, 1979.
- Thomas, J.A. & Marks, B.H.: Plasma norepinephrine in congestive heart failure. Am. J. Cardiol. 41:233, 1978.
- Klein, H.O. et al.: The influence of verapamil on serum digoxin concentration. Circulation 65:998, 1982.
- 坂井誠ほか:Ca拮抗薬の血清Digoxin濃度に及ぼす影響ーNifedipineとDiltiazemの比較検討ー. 薬理と治療11 (Suppl. 1): 11, 1983.
- Maragno, I. et al.: Low-and medium-dose diltiazem in chronic atrial fibrillation: Comparison with digoxin and correlation with drug plasma levels. Am. Heart J. 116:385, 1988.



