論文紹介LUCUBRATIONS
更年期症状への補完代替医療の最新知見ー科学的根拠を踏まえて
【補完代替医療それぞれの作用機序と効果:サプリメント】DHEA

臨床婦人科産科77(6):602-611, 2023.
- 米国ではDHEAは栄養補助食品と考えられているため、スーパーやドラッグストアなどで買うことができる。しかし日本をはじめ多くの国では医薬品として取り扱われている。
- 更年期の血管運動神経症状(VMS)と閉経関連泌尿生殖器症候群(GSM)に対する第一選択はホルモン補充療法であるが、難治性GSMに対してはDHEA膣剤も推奨される。
- 閉経後女性の性的欲求低下障害(HSDD)に対してDHEA経口補充の効果を示すエビデンスもあるが、最近のグローバル・コンセンサスはテストステロン補充を推奨している。
はじめに
米国では、DHEA(dehydroepiandrosterone:デヒドロエピアンドロステロン)はダイエタリーサプリメント(栄養補助食品)と考えられているため、スーパーやドラッグストアなどで買うことができる。しかし、表示されている量が含まれていないなど、品質管理が不十分であることが報告されている1)2)。一方、日本をはじめ多くの国では、DHEAは弱い男性ホルモン作用があることから、医薬品として取り扱われている。当院でも米国から個人輸入し、自費診療で処方して患者に提供している。DHEAを安全に服用するためには、血清DHEA-sulfate(DHEA-S)を定期的に測定し、生理的範囲にあることを確かめながら、医師が処方することが必要と考えている。
本稿に与えられたタイトルは「サプリメント-DHEA」であるが、誤解を招かないように、DHEAはサプリメントというより医薬品として認識されるべきことをはじめに断っておきたい。
DHEA補充の歴史
DHEAは加齢に伴い減少し、多くの疾患の発症率が高まる頃には、かなり低い濃度になることから、老化を遅らせたり、予防したりするホルモンと考えられ、1980年代からDHEA補充の考え方が広まり、投与がはじまった3)。一方では、DHEAは、血管拡張作用、抗老化作用、抗炎症作用、抗動脈硬化作用、抗うつ作用など多くの作用が基礎研究の結果で示されているが、それらを証明する臨床研究は、それほど多くはない。
本稿では、更年期症状への補完代替医療としてのDHEA補充の役割がテーマであるので、これに焦点を当て記載する。
DHEAとは
DHEAはヒトにおいて最も多く存在するステロイドホルモンである。生体内では硫酸化体のDHEA-Sとして99%が存在し、相互に変換される。体内のDHEA濃度を知るためには血清DHEA-Sを測定する。
図14)に示すように、DHEAは、副腎皮質網状層でコレステロールから合成される(30%)とともに、卵巣の莢膜細胞(20%)や末梢組織(30%)でDHEA-Sから変換されてつくられる5)。DHEAはアンドロステンジオンに、さらに精巣、卵巣などの末梢組織で、テストステロンや作用の弱いエストロゲンに変換される。また、テストステロンは脂肪組織、筋肉、肝臓などに広く存在するアロマターゼによりエストラジオールに変換される。
図1. ステロイドの代謝経路
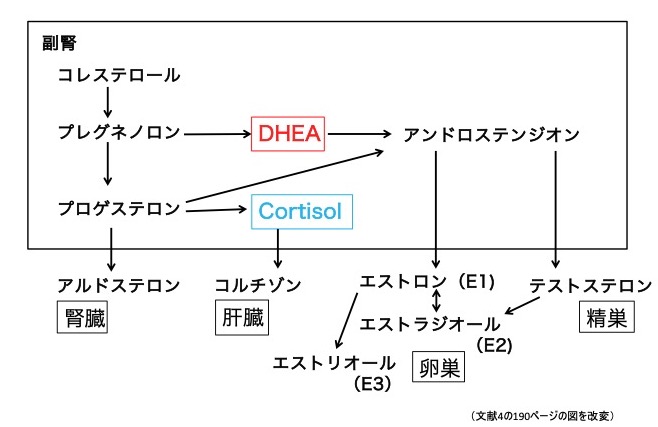 コレステロールからプレグネノロンを経てDHEAが作られる。DHEAはアンドロステンジオンを経てテストステロン、さらにエストラジオールへと変換される。DHEA:デヒドロエピアンドロステロン
コレステロールからプレグネノロンを経てDHEAが作られる。DHEAはアンドロステンジオンを経てテストステロン、さらにエストラジオールへと変換される。DHEA:デヒドロエピアンドロステロン
アンドロゲンは男性ホルモン作用を有するホルモンの総称で、DHEA、アンドロステンジオン、テストステロンなどを指す。エストロゲンは女性ホルモン作用をもつホルモンの総称で、エストロン、エストラジオール、エストリオールなどを指し、ヒトではエストラジオールが最も活性が高い。
卵巣でもDHEAとテストステロンは産生される
女性の卵巣ではエストロゲン、プロゲステロンの他に、DHEAとテストステロンも産生されている。閉経後は卵巣からのエストロゲン、プロゲステロン、DHEAの産生はなくなり、エストロゲン供給の90%は副腎のDHEAに由来する6)。一方、閉経後も卵巣からのテストステロン分泌は長年続くことが知られている7)が、それでもテストステロンの40〜75%は副腎のDHEA由来である6) 7)。
DHEA-Sは加齢とともに減少
図2に示すように8)、DHEA-Sは20歳前後でピークに達し、その後直線的に減少する。DHEAの低下が高度の場合、腋毛、恥毛の脱落として気づかれることもある。これは女性の腋毛、恥毛の発育が100%DHEAに依存しているからである。軽度の場合には、性欲の低下程度であり、自他覚的に気づかれにくい9)。
図2. 加齢に伴う血清DHEA-S濃度の変化
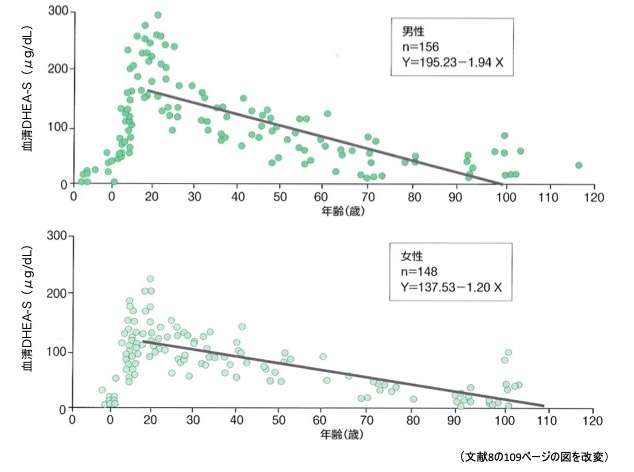 DHEA-Sは20歳前後でピークとなり、その後は加齢に伴って急速に低下する。DHEA-S:デオキシエピアンドロステロンサルフェイト
DHEA-Sは20歳前後でピークとなり、その後は加齢に伴って急速に低下する。DHEA-S:デオキシエピアンドロステロンサルフェイト
DHEAの作用
DHEAはテストステロンの10〜100分の1程度の弱い男性ホルモン作用を有する。
DHEAの作用は、変換されたテストストロンやエストロゲンによる作用と考えられる一方、DHEA固有の作用もあると考えられている。しかしDHEA固有の受容体の存在も含め、未だ一致した見解には至っていない。
DHEA経口投与で血中DHEA、テストステロン、エストラジオールは増加
血中DHEA-S濃度が若年者よりもかなり低い、閉経後女性および高齢男性に、1日50~100mgのDHEAを3~24ヶ月間経口投与すると、血中DHEA-S濃度は若年者と同等のレベルまで増加する10) 11) 12) 13) 14) 15) 16)。また、血中テストステロンとエストラジオールの濃度も女性ではわずかに増加する15)。
DHEA経口投与の副作用
女性におけるテストステロンの過剰は、ニキビ、多毛症、生理不順(無月経)、頭頂部脱毛、声の低音化、体型の男性化などを引き起こす3)。
DHEAの副作用として、1日50mg以上の用量では、ニキビ、顔の毛の成長=多毛症、脂性肌(皮膚が脂ぎる)などのアンドロゲン作用によるものが報告されているが17) 18)、重大な有害事象の報告はない。
思春期のざ瘡(ニキビ)は、その時期のDHEAの生理的増加と関連している。DHEAはヒト皮膚脂腺においてDHT(dihydrotestosterone)に変換され、ざ瘡の原因となる3)。
更年期の血管運動神経症状と閉経関連泌尿生殖器症候群に対する第一選択はHRT
2022年、北米閉経学会は5年ぶりに学会としての見解(Position Statement)を公表した19)。ホルモン補充療法(エストラジオールE+/-プロゲステロン=E+/-P)(以下HRTと略す)は、更年期の血管運動神経症状(Vasomotor symptoms、以下VMSと略す)と閉経関連泌尿生殖器症候群(Genitourinary syndrome of menopause:GSM)に対する最も効果的な治療法であり、また骨量減少と骨折を予防する、とした。
この声明の中で、HRTの適応がない女性で、市販の治療薬では緩和されない煩わしいGSMの症状に対しては、低用量のエストロゲン膣剤または他の治療法[例:DHEA膣剤またはospemifene(オスペミフェン、SERMの一つ)の経口投与]が推奨されるとした。このように北米閉経学会は、GSMに対してのみDHEA膣剤の使用を容認する立場である。
閉経関連泌尿生殖器症候群(GSM)とは
GSMとは、2014年に北米閉経学会と International Society for the Study of Women's Sexual Healthが提唱したもので20)、閉経に伴うエストロゲン低下で生ずる泌尿生殖器系の多くの症状を含む概念である。従来の外陰膣萎縮症(Vulvovaginal Atrophy:VVA)、萎縮性膣炎、尿失禁なども含まれる。ここではGSMの日本語訳として日本女性医学学会が提案した「閉経関連泌尿生殖器症候群」を使用した。
GSMの症状は、性器症状(乾燥、灼熱、刺激)、性交症状(潤滑不足、不快感または痛み、性機能障害)および泌尿器症状(切迫、排尿困難、再発性尿路感染症)などである21)。性機能とは性交回数、性的満足度、性欲などを意味する。
GSMには、閉経後女性の約84%が罹患しているとされる22)。4000人以上の更年期女性を対象とした国際調査では、GSMの約半数で生活の質の低下が報告されている23)。 50万人の女性からなる最近のケースコントロール研究では、GSMでない女性に比べて、GSMでは抑うつと不安のリスクが有意に高いことが明らかにされている24)。
更年期症状のうち血管運動神経症状(ほてり・のぼせ・ホットフラッシュ・発汗などの血管の拡張と放熱に関係する症状)は一般的に時間とともに軽快するが、GSMは治療しなければ、低エストロゲン状態が続く限り、症状は持続し、あるいは悪化することもある。GSMが女性の生活に悪影響を及ぼす可能性があるにもかかわらず、多くの女性が未治療のままである。
ポーランドの更年期医学会専門家会議の見解
2020年にポーランド男性女性更年期医学会専門家会議(expert panel of Polish Menopause and Andropause Society)は、閉経前及び閉経後のDHEA 補充についての見解(position statement)を公表した25)。
2020年の時点で報告されている臨床試験やメタアナリシスの論文をレビューし、DHEA補充は以下の状態に有効であることを示している。
①副腎機能不全を有する女性、②副腎皮質ステロイドホルモン剤によって慢性的に治療を受けている女性、③低骨密度や骨粗鬆症の閉経後女性、④性機能障害や性欲減退に悩む閉経前の女性、⑤閉経よる外陰膣萎縮症(VVA)あるいは閉経関連泌尿生殖器症候群(GSM)に悩む女性などである。VVAはGSMに含まれる概念であるが、GSMの提唱以前に文献で広く使用されているために、ここでは併記されていると思われる。
また、最近の臨床試験によってDHEA 補充がおそらく効果的である状態として以下をあげている。①性機能障害や性欲減退に悩む閉経後女性、②卵巣予備能の低下した不妊女性、③うつや不安に悩む女性、④肥満やインスリン抵抗性を有する女性、などである。
そして重要な点として、今までの臨床試験において重篤な副作用の報告が1つもみられないことを強調している。
本稿の主題は、更年期症状に対するエビデンスのあるDHEA補充なので、多くの専門家のコンセンサスが得られていると思われる、GSMに悩む女性と、性機能障害や性欲減退に悩む閉経前後の女性に対するDHEA補充ついて、以下に取り上げる。
GSMに対するスイスの学際的なコンセンサス会議の見解
2022年スイスでは、さまざまな医療分野から専門家を集め、GSMに対する治療の選択肢を科学的的根拠に基づいて公表した26)。この声明の中でも、非ホルモン性膣剤、エストロゲン膣剤、膣レーザー療法、オスペミフェン経口剤などとともに、DHEA膣剤を選択肢の一つとして上げている。
DHEA膣剤によるGSM治療
近年、膣内レーザー治療やDHEA膣剤などが、GSM治療の選択肢として追加された。
膣内レーザー治療は、本邦での保険適用はないが、モナリザタッチの呼称で一部の医療機関では自費診療で提供されている。
DHEA膣剤(6.5mg/日)は2016年に米国食品医薬品局(FDA)で商品名Intrarosa(一般名プラステロンprasterone)としてVVAによる性交痛の治療薬として承認された。その後、EU、英国、カナダ、スイスなどでも承認されて使われているが、本邦では未だ未承認である。
血中DHEA-S濃度は、血中テストステロンおよびエストラジオールの濃度よりはるかに高い。加齢に伴い、DHEA-Sとテストステロン濃度は減少し、閉経前後の両者の血中濃度は、若い女性と比べると約半分の濃度まで低下する27)。
GSM治療のためのDHEA膣剤の開発は、ほぼ20年前に始まった。DHEA膣剤は、エストロゲン膣剤とは異なる点がある。図3に示すように、DHEAは末梢の標的器官の細胞に入り、細胞内に局在する酵素によってテストステロンに、さらにエストラジオールに変換される28)。このようにして、DHEA、テストステロン、エストラジオールは細胞内でのみ作用を発揮し、同じく細胞内で不活性化されるため、全身に作用することはない。DHEA膣剤を毎日使用しても血中性ステロイド濃度の変化はわずかである29) 30)。同様に、6.5mgのDHEA膣剤を1年間毎日使用しても、子宮内膜の変化は認められない31)。DHEA膣剤の臨床試験で報告された最も頻度の高い副作用は、帯下の増加(患者の9.9%)であった。
図3. 膣細胞でのDHEAの作用
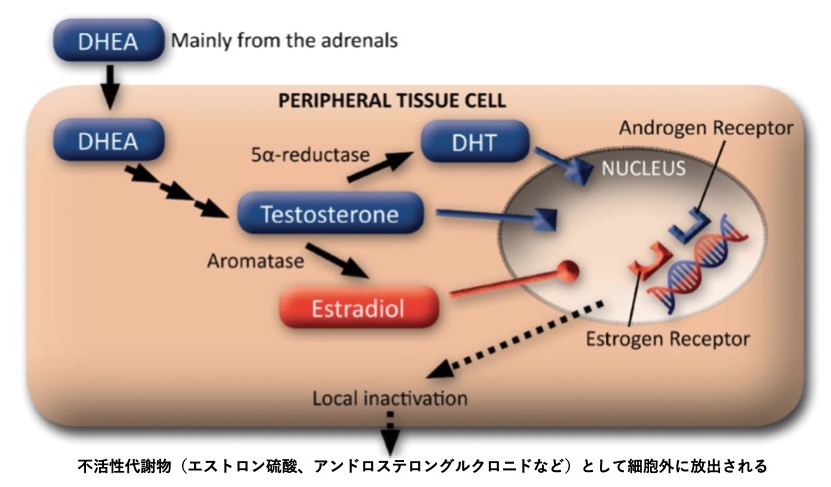 DHEA:デビドロエビアンドロステンジオン、DHT:ジビドロテストステロン(文献26より作成)
DHEA:デビドロエビアンドロステンジオン、DHT:ジビドロテストステロン(文献26より作成)
GSMのうち、特に中等度から重度の性交痛を有する女性に対して、DHEA膣剤(1日6.5mg)の有効性と安全性が、無作為化前向き二重盲検プラセボ対照臨床試験で検討された。その結果、DHEA膣剤を12週間使用したところ、傍基底細胞は減少(27.7%)、表層細胞は増(8.44%)、膣pHは低下(0.66pH)し、性交痛は改善した。一方、84.0%の女性にみられた中等度または重度の膣乾燥も、12週目には改善した。婦人科検診では、膣分泌物、上皮の完全性、上皮表面の厚み、色彩などがすべて改善した32)。12週間の臨床試験で示されたDHEA膣剤の有用性は、52 週間の臨床試験でも確認されている33)。
さらに、GSMに悩む女性に対してDHEA膣剤の効果を、女性性機能指数(FSFI)で検討したところ、すべての項目で性機能が改善した34)。
エストロゲン膣剤とは対照的に、DHEA膣剤は、膣上皮だけではなく、その下の細胞層にも有益な影響を与えている。卵巣摘出ラットにおいて、DHEA膣剤は固有層内の神経線維の密度および筋層内の交感神経線維の密度も増加させた35)。膣壁の交感神経線維の密度の増加は、膣壁のリズミカルな収縮(オーガズム)と膣の伸長と拡張を誘発すると考えられている。
乳がん生存者に対して、EUとスイスでは、DHEA膣剤は禁忌とされているが、米国臨床腫瘍学会のガイドラインでは、アロマターゼ阻害剤を使用しており、以前の治療が奏効しなかった乳癌患者あるいは生存者には、DHEA膣剤を推奨するとしている36)。さらに、後ろ向きコホート研究により、DHEA膣剤は乳癌再発リスク上昇と関連しないことが示されている37)。同様に、パイロット研究では、アロマターゼ阻害剤による治療を受けた乳がん生存者において、DHEA膣剤を使用しても血中エストロゲン濃度は増加しない38)。最後に、米国とカナダにおけるIntrarosa®の添付文書には、乳がん生存者の使用は禁忌との記載はない。
性機能障害や性欲減退に悩む閉経前後の女性に対するDHEA経口補充
女性の性欲とリビドーには、性ホルモンが関与している。副腎のアンドロゲンは正常な性機能に必要であり、アンドロゲン不足では性行為の頻度が低いことがわかっている。横断的および縦断的な研究において、血中テストステロンレベルと性機能は直接的な相関がないことが示されているが、性欲についてはテストステロンが主要な役割を担っている39)。一方、閉経前後の女性において、血中DHEA-Sが低いと性機能が低下することが示唆されている40)。
DHEA経口補充は、性機能改善に有効であることが認められているが、それでもなお閉経後女性の性欲に関するDHEA経口補充の効果は、特にDHEAの投与量と治療期間に関して、まだ一致した見解に達していない41)。
最新の研究では、閉経後早期の女性に1日10mgのDHEAを12ヶ月間経口投与し、McCoy Female Sexuality Questionnaire(MFSQ)を用いて評価した結果、性機能の改善と性交回数の有意な増加が認められている42)。
また、閉経前女性の性機能に対するDHEA 経口投与の効果についても検討されている43)。この観察研究では、平均年齢41歳の不妊女性を対象に、DHEA 25mgを1日3回投与した場合の女性性機能指数(FSFI)への影響を調べた。その結果、DHEA補充群では、FSFIスコアは7%、性欲スコアは17%、性的興奮スコアは12%、それぞれ増加した。一方、オーガズムと性的満足度のスコアには差がなかった。DHEA補充中に、FSFIスコアが最低四分位値でスタートした女性は、34%スコアが増加し、性欲(40%)、性的興奮(46%)、潤滑(33%)、オーガズム(54%)、性的満足度(24%)などで改善が示された。本研究は、FSFIスコアが低い閉経前女性においても、DHEA経口補充は性機能を改善することを示唆するものである。
閉経後女性に対するアンドロゲン補充は、数十年にわたり一部の医師によってなされ、主に男性用に承認されたテストステロン製剤の用量を変更して女性に使用してきた。このような状況を医学的エビデンスのもとに改善すべく、2019年、世界の主要学会の代表がベルリンに招かれ、女性に対するテストステロン補充についての世界的なコンセンサス・ポジション・ステートメントが起草されて公表された44)。この声明では、副腎機能が正常な閉経後女性の性的欲求低下障害(hypoactive sexual desire disorder:HSDD)に対して、DHEAの経口および膣剤の使用を推奨しないとしている。一方、閉経前の生理的な範囲内でのテストステロン補充は、閉経後女性の性機能改善に有用である、としている。
おわりに
卵巣予備能の低下した不妊女性に対する、あるいは骨粗鬆症の予防のための、DHEA経口補充の効果、またアンチエイジング医療の一環としてのDHEA経口補充、などについては、触れることができなかった。最近筆者が執筆した総説を参照いただきたい45) 46)。
文献
- Parasrampuria J, et al : Quality control of dehydroepiandrosterone dietary supplement products. JAMA 280:1565,1998.
- Thompson RD, et al: Liquid chromatographic determination of dehydroepiandrosterone (DHEA) in dietary supplement products. J AOAC Int 83:847-857,2000.
- Rutkowski K, et al: Dehydroepiandrosterone (DHEA): hypes and hopes. Drugs74:1195-1207, 2014.
- 色本涼, 他:心身ストレスの検査と評価. アンチエイジング医学の基礎と臨床(第3版)(日本抗加齢医学会専門医・指導士認定委員会編). pp189-190, メジカルビュー社, 2015.
- Rabijewski M, et al : Supplementation of dehydroepiandrosterone (DHEA) in pre- and postmenopausal women – position statement of expert panel of Polish Menopause and Andropause Society. Ginekologia Pol 91:554–562, 2020.
- Klinge CM, et al : Dehydroepiandrosterone Research. Past,Current,and Future. Vitam Horm 108:1–28, 2018.
- Longcope C : Adrenal and gonadal androgen secretion in normal females. Clin Endocrinol Metab 15:213–228, 1986.
- 柳瀬敏彦:副腎ホルモン. アンチエイジング医学の基礎と臨床(第3版)(日本抗加齢医学会専門医・指導士認定委員会編).pp108-109, メジカルビュー社, 2015.
- 柳瀬敏彦:女性におけるテストステロンの意義. 日本女性医学誌 27:548-551, 2020.
- Morales AJ, et al :Effects of replacement dose of dehydroepiandrosterone in men and women of advancing age. J Clin Endocrinol Metab 78:1360-1367, 1994.
- Labrie F, et al: Effect of 12-month dehydroepiandrosterone replacement therapy on bone, vagina, and endometrium in postmenopausal women. J Clin Endocrinol Metab 82:3498-3505, 1997.
- Morales AJ, et al : The effect of six months treatment with a 100 mg daily dose of dehydroepiandrosterone (DHEA) on circulating sex steroids, body composition and muscle strength in age-advanced men and women. Clin Endocrinol (Oxf) 49:421-432,1998.
- Flynn MA,et al: Dehydroepiandrosterone replacement in aging humans. J Clin Endocrinol Metab 84:1527-1533, 1999.
- Arlt W, et al: Dehydroepiandrosterone supplementation in healthy men with an age-related decline of dehydroepiandrosterone secretion. J Clin Endocrinol Metab 86:4686-4692, 2001.
- Nair KS,et al: DHEA in elderly women and DHEA or testosterone in elderly men. N Engl J Med 355:1647-1659, 2006.
- Baulieu EE,et al: Dehydroepiandrosterone (DHEA), DHEA sulfate, and aging: contribution of the DHEAge Study to a sociobiomedical issue. Proc Natl Acad Sci U S A 97:4279-4284, 2000.
- Kroboth P, et al: DHEA and DHEA-S: a review. J Clin Pharmacol 39:327-348, 1999.
- Panjari M, et al: DHEA for postmenopausal women: a review of the evidence. Maturitas 66:172-179, 2010.
- The 2022 hormone therapy position statement of The North American Menopause Society. Menopause 29: 767-794, 2022.
- Portman DJ, et al: Vulvovaginal Atrophy Terminology Consensus Conference Panel. Genitourinary syndrome of menopause: new terminology for vulvovaginal atrophy from the international society for the study of women’s sexual health and the North American Menopause Society. Menopause 21:1063–1068, 2014.
- Kim H-K, et al: The recent review of the genitourinary syndrome of menopause. J Menopausal Med 21: 65–71, 2015.
- The 2020 genitourinary syndrome of menopause position statement of the North American menopause society. Menopause 27: 976–992, 2020.
- Nappi RE, et al:Women’s voices in the menopause: results from an international survey on vaginal atrophy. Maturitas 67: 233–238, 2010.
- Moyneur E, et al: Prevalence of depression and anxiety in women newly diagnosed with vulvovaginal atrophy and dyspareunia. Menopause 27: 134–142, 2020.
- Rabijewski M, et al: Supplementation of dehydroepiandrosterone (DHEA) in pre- and postmenopausal women – position statement of expert panel of Polish Menopause and Andropause Society. Ginekologia Pol 91: 554–562, 2020.
- Stute P, et al: Swiss consensus on the role of DHEA in the management of genitourinary syndrome of menopause. Climacteric 25: 246-256, 2022.
- Lobo RA: Androgens in postmenopausal women: production, possible role, and replacement options. Obstet Gynecol Surv 56: 361–376, 2001.
- Labrie F: Intracrinology and menopause: the science describing the cell-specific intracellular formation of estrogens and androgens from DHEA and their strictly local action and inactivation in peripheral tissues. Menopause 26: 220–224, 2019.
- Ke Y, et al: Serum steroids remain within the same normal postmenopausal values during 12-month intravaginal 0.50% DHEA. Horm Mol Biol Clin Investig 24: 117–129, 2015.
- Martel C, et al: Serum steroid concentrations remain within normal postmenopausal values in women receiving daily 6.5mg intravaginal prasterone for 12 weeks. J Steroid Biochem Mol Biol 159:142–153, 2016.
- Portman DJ, et al: Lack of effect of intravaginal dehydroepiandrosterone (DHEA, prasterone) on the endometrium in postmenopausal women. Menopause 22: 1289–1295, 2015.
- Labrie F, et al: Efficacy of intravaginal dehydroepiandrosterone (DHEA) on moderate to severe dyspareunia and vaginal dryness, symptoms of vulvovaginal atrophy, and of the genitourinary syndrome of menopause. Menopause 25: 1339–1353, 2018.
- Labrie F, et al: Prasterone has parallel beneficial effects on the main symptoms of vulvovaginal atrophy: 52-week open-label study. Maturitas 81: 46–56, 2015.
- Labrie F, et al: Effect of intravaginal prasterone on sexual dysfunction in postmenopausal women with vulvovaginal atrophy. J Sex Med 12: 2401–2412, 2015.
- Pelletier G, et al: Effects of ovariectomy and dehydroepiandrosterone (DHEA) on vaginal wall thickness and innervation. J Sex Med 9 2525–2533, 2012.
- Carter J, et al: Interventions to address sexual problems in people with cancer: American society of clinical oncology clinical practice guideline adaptation of cancer care Ontario guideline. J Clin Oncol 36:492–511, 2018.
- Moyneur E, et al: Absence of increase in the incidence or recurrence of breast cancer in women diagnosed with vulvovaginal atrophy (VVA) treated with intravaginal prasterone (DHEA) on the risk of breast cancer: A retrospective matched cohort study. 19th world congress of Gynaecological Endocrinology, 2020.
- Dury A, et al: Serum estrogen levels do not increase following intravaginal administration of prasterone (DHEA) in women treated with an aromatase inhibitor for breast cancer – results from a pilot study. 19th world congress of Gynaecological Endocrinology, 2020.
- Davison SL, et al: Androgen Levels in Adult Females: Changes with Age, Menopause, and Oophorectomy. J Clin Endocrinol Metab 90: 3847–3853, 2005.
- Davis SR. Circulating Androgen Levels and Self-reported Sexual Function in Women. JAMA 294: 91–96, 2005.
- Genazzani AR, et al: DHEA therapy in postmenopausal women: the need to move forward beyond the lack of evidence. Climacteric 13: 314–316, 2010.
- Genazzani AR, et al: Effect of 1-year, low-dose DHEA therapy on climacteric symptoms and female sexuality. Climacteric 14: 661–668, 2011.
- Kushnir VA, et al: Effects of dehydroepiandrosterone (DHEA) supplementation on sexual function in premenopausal infertile women. Endocrine 63: 632–638, 2019.
- Davis SR, et al: Global Consensus Position Statement on the Use of Testosterone Therapy for Women. J Clin Endocrinol Metab 104: 4660–466, 2019.
- 満岡孝雄:誌上DEBATE「DHEA補充」「Yesの立場から」. アンチ・エイジング医学-日本抗加齢医学会雑誌18:36-41, 2022
- 満岡孝雄:「老い対策」としてのアンチエイジング医療〜高齢者に対するホルモン補充療法を考える〜. アンチ・エイジング医学-日本抗加齢医学会雑誌 14: 26-34, 2019.



