論文紹介LUCUBRATIONS
特集不整脈の最前線:不整脈患者の背景
QT延長症候群

特集不整脈の最前線
不整脈患者の背景
QT延長症候群
満岡孝雄、深谷真彦
Medical Way 5(2):33 - 36, 1988.
はじめに
QT延長症候群は,著明なQT延長、torsade de pointes(Tdp)と呼ばれる特殊な心室頻拍あるいは心室細動、これによる失神発作や急死などを特徴とする症候群である。QT延長症候群の原因は表1に示すように、遺伝性と二次性とに大別されるが、原因により治療が異なることもあるため、その鑑別は重要である。
表1. QT延長症候群の原因(文献4)より引用・改変)
| 遺伝性QT延長症候群 | |
| 遺伝型 | Jervell and Lange-Nielsen症候群 Romano-Ward症候群 |
| 孤発型(特発性) | |
| 二次性QT延長症候群 | |
| 薬剤によるもの | 表3を参照のこと | 電解質異常 | 低カリウム血症 低マグネシウム血症 低カルシウム血症 |
| 中枢神経系障害 | くも膜下出血 急性脳血栓症 頭部外傷 |
| 高度徐脈性不整脈 | |
| その他 | 急性心筋炎、僧帽弁逸脱症候群、心筋虚血/心筋梗塞、甲状腺機能低下症、人エペースメーカー機能異常、急激な体重減少(低カロリー性食事療法、very-low-energy diets、300〜400カロリー/日、空回腸バイパス術、神経性食欲不振などによる) |
遺伝性QT延長症候群
遺伝性QT延長症候群(本症候群)は、Jervell and Lange-Nielsen症候群とRomano-Ward症候群よりなる。Jervell and Lange-Nielsen症候群は、先天性聾啞を伴い、常染色体性劣性遺伝であるため、通常は孤発または同胞発症に限られる。その頻度はきわめて稀で、失神発作や急死の発生は幼若な年齢のことが多く、本症候群の中でより重症なものと考えられている。
これに対してRomano-Ward症候群は先天性聾啞を伴わず、単純常染色体性優性遺伝であるために、それぞれの家系内で親子関係の縦の世代に連続して多発するのが特徴である。遺伝関係が不明ないしは調査困難な孤発例もしばしば認められるが、そのような例は特発性QT延長症候群として上記の二つのものとは区別している。
1.病因
本症候群の病因は必ずしも明確でないが、主に動物実験の成績からの推論では、心室に対する左右の交感神経支配の先天的な不均衡の関与が大きいと考えられている3)。すなわち、心室に対する自律神経支配は左右一様ではなく、左側は心室後壁に、右側は心室前壁に分布するとされているが、主として心室に対する右交感神経支配緊張の低下により心室に対する左交感神経支配の相対的な優位状況が生じる。このため心室の前壁領域での再分極過程の遅延が起こり、心室内の再分極過程の不均一性(dispersion)、すなわち心室不応期の部位差が大となってQTが延長し、さらに心室細動閾値も低下する。
このような状況では、運動や感情興奮などにより心室に対する左右の交感神経支配の不均衡がさらに高まれば、容易に心室性不整脈が発生すると考えられている。
一方、本症候群の本質的な異常は細胞膜を構成するタンパク質の先天的な異常であり、これによって再分極過程の第3相で起きる細胞内カリウムの流出が障害されるという説も、最近示されている。
2.長期予後
当科で経験したRomano-Ward症候群の13家系131例についての平均7.2年にわたる長期観察の結果1)2)では、観察期間中における急死は5例(3.8%、年間0.5%)、失神発作は14例(10.7%、年間1.5%)、QT延長のみで症状のない例が58例 (44.3%)で、QT延長も症状も認めない例が54例(41.2%)であった。
また興味ある所見として、1)失神発作の初発年齢や急死の発生には性差が認められ、男性ではほとんどが10歳未満で発症し、20歳以後になると症状の軽快を認める例もあるのに対して、女性では10歳以後に発症することが多く、30歳以後の初発例も少なくない、2)観察期間中、13家系中の10家系においては急死例や失神発作例を認めたが、3家系においてはそのいずれもが認められず、QT延長のみを示す無症状家系の存在が示唆された、3)Romano-Ward症候群の遺伝形式からは理論的には家系内の半数が遺伝子を継承することになり、男女比も同率のはずであるが、実際は男性に 比較して女性にQT延長例が多い(49%対68%)、などが観察された。
3.診断および検査
本症候群の診断は、失神発作の特徴、非発作時心電図の著明なQT延長、さらに家系調査を行えば比較的容易である。特徴的な臨床症状は、激しい運動や感情興奮を契機として生ずる数秒ないし20〜30秒間の比較的短い失神発作で、重篤な場合には急死に至る。程度が軽い場合は、眼前暗黒感、めまい感、動悸などが主訴となることもある。これらの発作症状は程度の差こそあれ同一の機序、すなわちtorsade de pointes(Tdp)と呼ばれる重症のきわめて特殊な心室頻拍にて発生する。
図1にRomano-Ward症候群の例の失神発作中の心電図記録を示すが、QT(U)c間隔は0.52〜0.54秒と著明に延長し、T波の比較的終末部近くの心室性期外収縮に続いてTdpが生じ、約15秒後に自然停止している。本症候群の心電図所見は、著明なQT延長と奇異なT波の波形が特徴的である。
図1. Romano-Ward症候群の1例におけるTdp(73歳、女性)
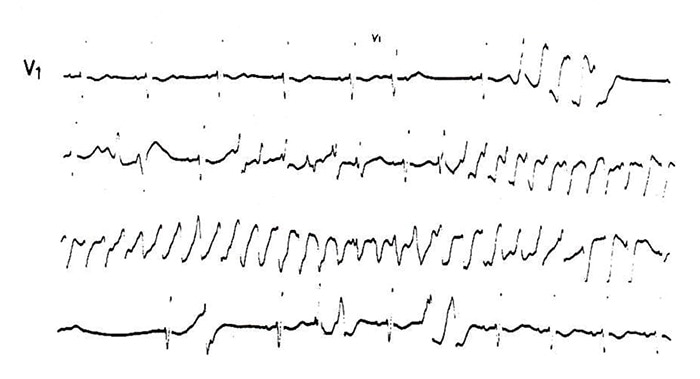
われわれの施設ではBazettのQTcで0.46秒以上をQT延長と判断しているが、典型例では通常0.50以上を示すことが多い。家系調査は本症候群の診断上きわめて重要であるため広範囲にわたって行う必要がある。
この他に、安静時に洞性徐脈を示し、運動負荷にても心拍数が健常人ほど増加しない、また、運動負荷やValsalva試験によってQT延長、異常T波の増悪、心室性頻拍性不整脈などが誘発されることなどが報告されている。
4.治療の適応
失神発作を有する患者は、その失神発作が突然死に結びつく可能性があることから治療の絶対的な適応である。また、心室期外収縮やその連発が認められるQT延長例も、同様に治療の適応と考えられる。未だ失神発作もなく、心室性期外収縮も認めないQT延長のみの症例に対しては、初回発作が生じるまでは治療を開始せず、定期的な経過観察を行う。
5.治療
表2に本症候群の治療に関してまとめた。Tdpによる発作が頻発している時には、心臓ペーシングが最も有効とされ、心室細動に移行した場合には、直流除細動が行われる。isoproterenolは本症候群においてはTdpをむしろ誘発する可能性があるため、また、I-A群の抗不整脈剤もQTを延長するという点で禁忌に近いと考えられる。発作の予防にはβ遮断剤が最も有効と考えられているので、なるべく長期間にわたり投与する。また、心室性期外収縮の抑制とQT短縮の目的で、I-B群の抗不整脈剤、特にmexiletine、diphenylhydantoinなども試みられる。
表2. 遺伝性QT延長症候群の治療
| 1.一般的な留意点 | ||
| ①発作の誘因となる運動や感情興奮などを避ける | ||
| ②失神発作が生じた時には直ちに病院に移送する | ||
| 2.Tdpによる発作中の治療 | ||
| ①心室性期外収縮の抑制のためlidocaineの静注・点滴 | ||
| ②心臓ペーシング(80〜120/分の刺激頻度)を施行 | ||
| ③心室細動に移行した場合には直流除細動(isoproterenol, IA群の抗不整脈剤はむしろ禁忌) | ||
| 3.長期治療 | ||
| ①薬物治療 | ||
| 1)propranolol 60〜120mg/日/分3 またはatenolol 10〜50mg/日/分1 | ||
| 2)1)のみで無効の場合 mexiletine 300〜400mg/日/分3〜4 または diphenylhydantoin 200〜300mg/日/分3 | ||
| 3)鎮静あるいは精神安定剤 | ||
| ②左側星状神経節切除術 | ||
| ③時に人エペースメーカー植込みを考慮 | ||
感情興奮などによる交感神経緊張を抑制するために、鎮静あるいは精神安定剤が用いられることもある。
β遮断剤服用にても反復する失神発作が起こるようであれば、左星状神経節切除術が考慮されることもある。しかし、左星状神経節切除術の長期の発作予防効果については必ずしも一致した見解に達していない。長期心室ペーシングは発作予防には一般に無効とされているが、β遮断剤の大量投与や左星状神経節切除術が無効であった例に、恒久的心房あるいは心房心室順次ぺーシングを試み著効を認めたとの報告がある。これらの症例の一部はβ遮断剤投与により徐脈が認められており、ペーシングによる心拍数の増加が失神発作の予防に働いた可能性が考えられる。
二次性QT延長症候群
1.原因
表1および表3に二次性QT延長症候群(QTPS)の原因を示しているが、この中で通常認められるものは抗不整脈剤によるもので、他の原因によるものは少ない。抗不整脈剤の他に比較的認められるQTPSはフェノチアジン系、三環系、炭酸リチウムなどの向精神薬によるもので、これらの薬剤の電気生理学的特性はquinidineのそれと類似している。
表3. 二次性QT延長症候群の原因となる薬剤(文献5)より引用・改変)
| 抗不整脈剤 | IA群 | quinidine、procainamide、disopyramide、ajmaline |
| IB群 | aprindine | |
| III群 | N-acetylprocainamide、amiodarone、sotalol | |
| 血管拡張剤 | prenylamine、bepridil | |
| 向精神薬 | フェノチアジン系、三環系、炭酸リチウム | |
| その他 | predonisone、furosemide、ketanserin(antagonist of 5-HT2-serotonergic receptor)、astemizole(抗ヒスタミン剤) | |
| 毒性物質 | 有機リン酸塩殺虫剤 | |
2.抗不整脈剤によるQTPS
quinidine、procainamide、disopyramideなどのI-A群、およびamiodarone、sotalolなどのⅢ群の抗不整脈剤はQT延長をもたらし、Tdpの原因となる。これに対して、lidocaine、tocainide、mexiletineなどのI-B群の抗不整脈剤はQT延長をもたらすことなく、Tdpの原因になることも稀である。quinidineは最もしばしば認められるQTPSの原因であるが、初回投与の数時間後でも、あるいは長期投与中でも発生し、薬剤の血中濃度とは無関係に生じてくる。したがって、quinidine投与開始は必ず入院中に行うことが勧められる。
procainamideは中毒量によってはQTPSを起こすことがあるが、通常量では稀である。静注で起こすことより、慢性の経口投与で起こしやすい。procainamideは体内でN―acetylprocainamideに代謝され、これ自体がQT延長をもたらし、Tdpの原因となる。
3.症例
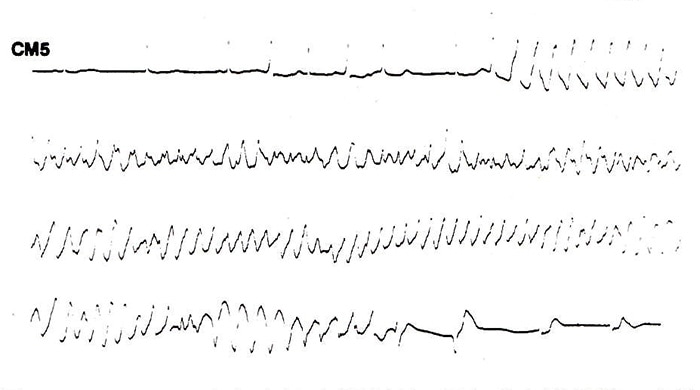
図2にdisopyramideにて生じたTdpの実例を示す。症例は57歳女性で、心室性期外収縮が多発するためにdisopyramide 300mg/日を投与された。約7ヵ月後、自宅玄関にて隣人と会話中に突然に失神発作を生じ、当科に緊急入院した。観察室にて経過観察中、同様の失神発作を生じ、脈拍は触知不能で、この時の心電図が図2に示したものである。図2は典型的なTdpで、一見心室細動・粗動様で、心拍数は240/分ときわめて速くかつ不規則で、また、心室波も基線より上向きになったり下向きになったりしながら不規則に変動している。発作は35秒後に自然停止した。
QTcの経過はdisopyramide投与前0.40秒で、投与後より徐々に延長し、発作の4日前には0.59秒と著明に延長していた。さらに発作の3日前に胃透視を行った後に下痢があり、当科入院時の血清Kが3.3mEq/1と低値を示した。本例は著明なQT延長に低K血症が加わり、Tdpを生じたと考えられた。
図2. disopyramideにおけるQT延長・Tdpの1例(57歳、女性)
4.薬剤によるQTPSの発生要因・機序
抗不整脈剤を投与されている多くの症例の中で、どの例かQTPSを起こしてくるか同定することは容易ではないが、留意すべき事項を表4に示した。
表4. 抗不整脈剤投与例におけるTdpの予防のための留意点
| 1. | ①治療前にQTcが0.44秒以上を示す例 | |
| ②治療後にQRS幅が25%以上に増大あるいはQTcが0.60秒以上に延長した場合はTdpを起こす可能性が高くなる | ||
| 2. しかし0.60秒以下でも多くの例がTdpを起こすので、QT延長の程度はTdpの適切な指標とはなりにくい | ||
| 3. 血中濃度が中毒量にならないように留意する。しかし血中濃度が治療域あるいはそれ以下のレベルでも、特にquinidineやdisopyramideではTdpを起こす | ||
| 4. 低K血症などの電解質異常がしばしば認められる | ||
| 5. Tdpの発生直前には以下の心電図所見がしばしば認められる | ||
| ①T波のalternansあるいは多形性心室頻拍のshort runの出現 | ||
| ②長い周期後のT波の形や高さの変化(post-pause T wave changes) | ||
| ③長い周期の後に短い連結期でT波の終末部周辺あるいはU波の上におちる心室性期外収縮(late-cycle VPCを伴う "long-short" sequence) | ||
QTPSの発生と薬剤の投与量および血中濃度との関係は、十分に明らかでない。QTPSは、薬剤の血中濃度が治療域あるいはそれ以下のレベルにある時でも生じる。同じ薬剤を以前に投与した時にはQTPSの発生はなかったのに、再投与でQTPSが発生した症例もある。薬剤誘発のQTPSの症例の約1/4は、投与開始3〜4日目でQTPSを生じるが、残りの症例では投与開始の数ヵ月後あるいは数年後に発生し、この後発のTdpには投与量の変更、電解質異常、徐脈性不整脈の発生などがしばしば関係している。
薬剤によるQTPSの発生機序は未だ明らかではないが、犬のPurkinje線維を用いた灌流実験で、低濃度のquinidine投与下に低Kとして低頻度でのペーシングを行うと、常にearly afterdepolarization、triggered activityを誘発できることが微小電極法によって観察され、quinidine誘発のTdpはtriggered automaticityによるものと推測されている。
5.治療
表5に薬剤により生じたTdpの治療について示した。
表5. QT延長を伴うTdpの発作中の治療
| ・薬剤により生じた場合 | ||
| ①誘因となった薬剤を直ちに中止 | ||
| ②心臓ペーシング(80〜120/分の刺激頻度)やisoproterenol点滴静注(1〜4μg/分)により心拍数を増加 | ||
| ③電解質異常などがあれば補正 | ||
| ④硫酸マグネシウムの静注、lidocaine、mexiletineなどの静注が症例によっては有効(IA群の抗不整脈剤はQT延長をきたすため禁忌) | ||
| ⑤心室細動に移行した場合には直流除細動 | ||
| ・緊急例でTdpの原因が明らかでない場合 | ||
| ①心臓ペーシングを最初に行う | ||
| ②二次性か遺伝性かの原因を明らかにし、それぞれの治療を行う | ||
文献
- Hashiba, K., Mitsuoka, T., Mori, M., et al : The QT prolongation syndrome ; Long-term follow-up study of 13 families with Romano-Ward syndrome, Proceedings of lnternational Symposium on Comparative arrhythmology, 13th Annual Meeting of the Research Group on Comparative Electrophysiology, edited by Watanabe, Y., Heart and Vessels, in press, 1987.
- 橋場邦武: 日内会誌, 76:21, 1987.
- Schwartz, P. J. and Locati, E.: Eur. Heart J., 6 (Suppl. D): 103, 1985.
- Bhandari, A., Scheinman, M.: Mod. Conc. Cardiovasc. Dis., 54: 45, 1985.
- Stratmann, H. G.: Am. Heart J., 113: 1470, 1987.



